基础实验——P区非金属元素(二)(氮族、硅、硼)
一、实验目的
1、 掌握氮的不同氧化态的化合物的主要性质。
2、 掌握磷酸盐的酸碱性和溶解性。
3、 掌握硅酸盐、硼酸盐、硼砂的主要性质。
二、实验原理
氮元素的氧化态极其丰富,从-3到+5可以形成一系列不同氧化态的化合物。-3氧化态的主要为NH3及其盐。铵盐不稳定,受热易分解,其分解产物由组成铵盐的酸根来决定。
氮的含氧酸及其盐,主要为+3和+5两种氧化态,常见的为亚硝酸及其盐和硝酸及其盐。+3氧化态的化合物,既有氧化性又有还原性,在反应中表现什么性质,取决于反应对象。
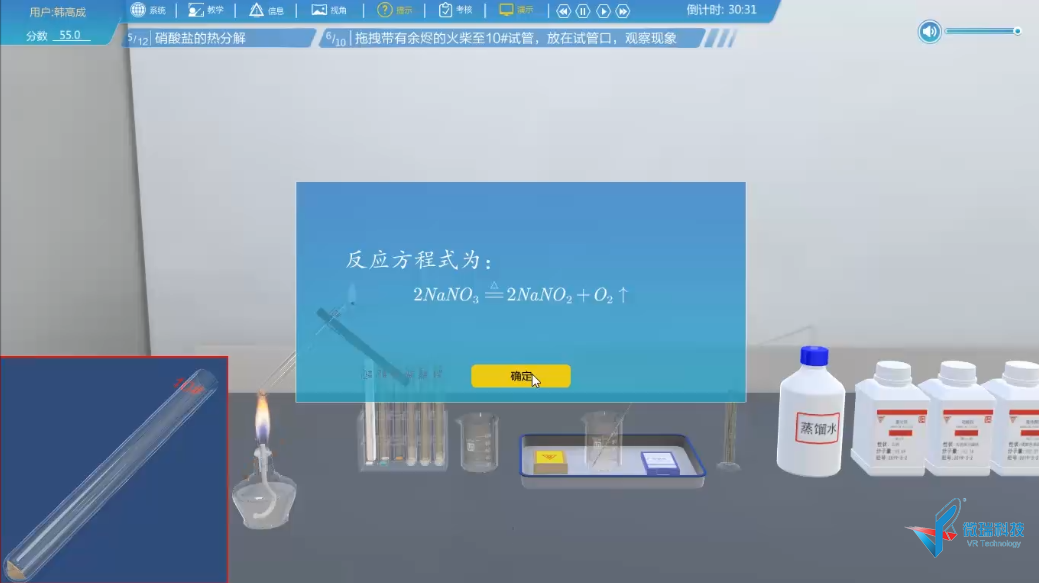
硝酸有很强的氧化性,其还原产物取决于酸的浓度及反应物的活泼性。硝酸盐受热分解的难易程度及分解产物,取决于阳离子。
磷酸属于三元酸,可以形成正盐、一氢盐和二氢盐。易溶于水的正盐在水中水解,溶液显碱性,一氢盐和二氢盐在水中发生水解和氢离子解离两种行为,其溶液的酸碱性,取决于水解和氢离子解离两种程度的相对大小,若水解大于电离,则溶液显碱性,反之为酸性。
磷酸盐的溶解性、正盐、一氢盐除ⅠA盐、NH4+盐易溶,其余的均难溶于水;所有的二氢盐均易溶于水。不管哪种可溶性盐的水溶液中,均存在着PO43-、HPO42-、H2PO4-三种酸根离子,这三种盐在一定的条件下可以相互转化。
磷酸根是一种较常用配合剂,常用来掩蔽某些金属离子。
硅酸是一种不溶性的酸,常以硅酸凝胶的形式存在。硅酸盐中,除了ⅠA的盐可溶外,其余的盐均难溶于水。
在可溶性的硅酸盐(钠盐)中,加入例如CaCl2、CuSO4等固体盐,放置一段时间后,可以形成钟乳石状的硅酸盐石笋,俗称水中“花园”。
硼酸是一种缺电子化合物,其水溶液中酸性以及加入多元醇酸性的增强,都是缺电子化合物性质的具体体现。
利用硼酸乙酯燃烧时的特征焰色,可用于硼酸根离子的鉴定。
三、实验内容
1、铵盐的分解
2、亚硝酸的生成和分解
3、亚硝酸的氧化还原性
4、硝酸的氧化性

5、硝酸盐的热分解
6、磷酸盐的酸碱性
7、磷酸盐的溶解性
8、磷酸盐的配位性
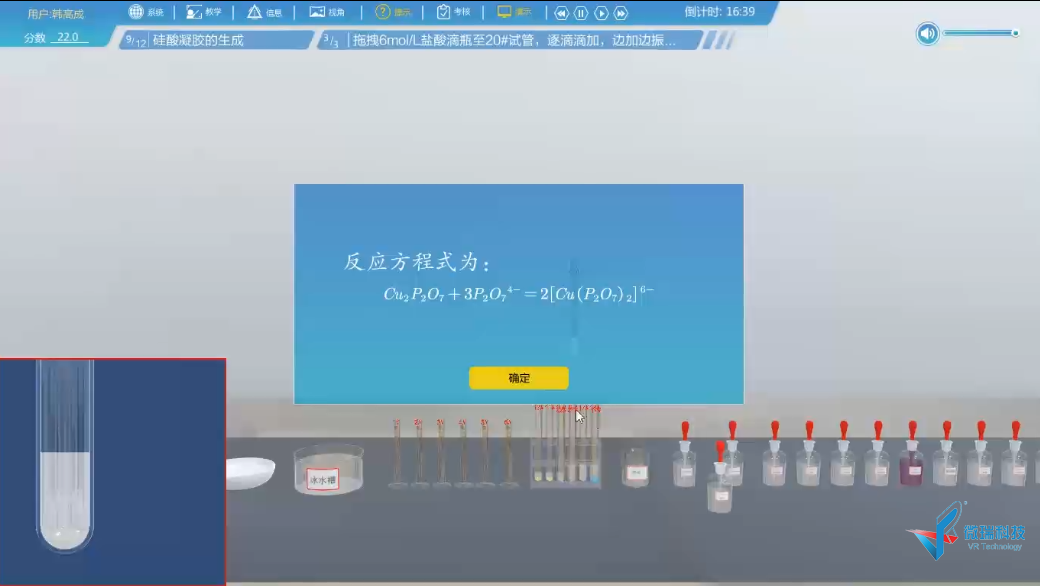
9、硅酸凝胶的生成
10、微溶性硅酸盐的生成

11、硼酸的性质
12、硼酸的鉴定反应

下一篇:基础实验——阿司匹林的制备

 售前咨询专员
售前咨询专员
